| Notícias | ||||||||||||||
19/01/2009 |
||||||||||||||
| Pesquisador do CNPq em parceria com norte-americanos descobre novos caminhos para estudos contra o câncer Os pesquisadores têm um novo alvo
nos estudos sobre o câncer. A descoberta foi publicada na Revista
Nature, de dezembro de 2008, no artigo do pesquisador do
CNPq e da Divisão de Hematologia do Departamento de Clínica Médica
da Faculdade de Medicina de Ribeirão Preto da USP (FMRP-USP), Eduardo
Rego, que apresentou as evidências do envolvimento de uma proteína
ribossomal, denominada L24, no desenvolvimento do câncer do sistema
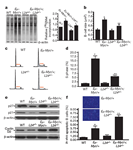
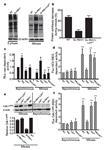
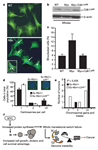
linfático, os linfomas. A pesquisa, que já é resultado do Instituto Nacional de Ciência e Tecnologia de Células-Tronco e Terapia Celular (INCTC), foi realizada em parceria com os pesquisadores Davide Ruggero e Maria Barna, da Universidade de São Francisco, na Califórnia, e representa o primeiro estudo sobre o papel da L24 e dos ribossomos na gênese do câncer. “O conceito clássico que temos de câncer é uma doença genética, hereditária, que na maioria das vezes vem de mutações no DNA. Como o fluxo da informação genética seria do DNA, para o RNA e para a proteína, assumíamos que uma vez mutado o DNA, o resto simplesmente carregaria a informação errada”. Neste sentido, as pesquisas sobre câncer primordialmente, na fase da quimioterapia, buscavam drogas que simplesmente inibiam a divisão celular, mas este mecanismo é extremamente inespecífico, matando, a grosso modo, qualquer célula que se divide, explicou Rego. Depois, durante muito tempo, as pesquisas procuravam criar terapias gênicas para “consertar” o gene mutado, mas até agora estas abordagens tiveram sucesso limitado e não avançamos além dos modelos animais de cânceres humanos. As pesquisas de Eduardo Rego, que já duram cerca de sete anos, focaram outra linha de estudo: as proteínas ribossômicas. “Conseguimos demonstrar que a parte da síntese protéica também é inteligente e, se alterada, ela vai fazer parte da gênese do câncer”. A pesquisa Foi escolhido um modelo clássico para o estudo: os linfomas associados ao aumento da expressão de um gene, o Myc, (um protoncogene). Segundo o pesquisador, os linfomas são o quinto tipo de câncer mais freqüente no mundo, e em vários casos, a doença está associada à uma quebra cromossômica, que causa o deslocamento do Myc e sua fusão em uma outra região do genoma. Pela “influência desta nova vizinhança”, o Myc acaba sendo expresso em níveis aumentados, o que leva a uma replicação anormal da célula. Rego revela que as pesquisas anteriores não mostram exatamente como funciona a informação para a célula se dividir. “Nós vimos que na célula do linfoma primeiro há um aumento da síntese de proteína, que se acumulam até um nível crítico refletido no aumento do tamanho da célula, e ao atingir este limite ela tem que se dividir”. Esta síntese de proteína, que ocorre na célula, é feita nos ribossomos, pelas chamadas proteínas ribossômicas. Elas não sintetizam as proteínas indiscriminadamente, e o balanço entre a síntese de proteínas dependentes de seqüências-guia chamadas Cap e aquela de proteínas dependentes de seqüências-guia chamadas IRES é essencial para a estabilidade do genoma e a correta divisão celular. “Nós conseguimos demonstrar que a proteína ribossômica L24 funciona como um reostato. Na verdade, ela recebe a informação a partir do myc, mas sua ação é fundamental para determinar o balanço CAP/IRES e conseqüentemente o comando de dividir”. Clique nas imagens para ampliar
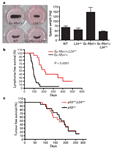
Teste Os testes foram realizados com camundongos transgênicos que superexpressam o Myc e consequentemente desenvolvem o linfoma. Os autores produziram camundongos geneticamente modificados para expressarem menos a proteína ribossomal (camundongos com haploinsuficiência do gene para a L24) e os cruzaram com os transgênicos. O cruzamento dos gene de altos níveis de Myc com o níveis baixos de proteína ribossômica resultaram no bloqueio da ação maligna do Myc, pois os filhotes não desenvolveram tumores, apesar de possuírem a mensagem para desenvolver os linfomas. “Percebemos que esse mecanismo ribossômico é realmente inteligente, capaz de controlar a divisão celular, e que ao manipularmos a expressão da L24 revertemos a transformação maligna, neste exemplo aquela causada pelo Myc”, disse o pesquisador. Próximos passos “Com este novo alvo levantamos agora possibilidades de estudo para um novo tratamento com a diminuição da proteína ribossômica”, disse. Rego explicou que a pesquisa partirá agora para confirmar a importância dessa proteína nas amostras com seres humanos. “Vamos testar in vitro, usando amostras de linfomas, se o mesmo mecanismo existe nas células humanas, e usar RNA interferências para diminuir a expressão da L24 e verificar se isto leva a regressão completa do tumor”, conclui. Confira o artigo completo em: http://www.cnpq.br/saladeimprensa/noticias/2009/0119_artigo.pdf Assessoria de Comunicação Social do
CNPq
|